Recherche
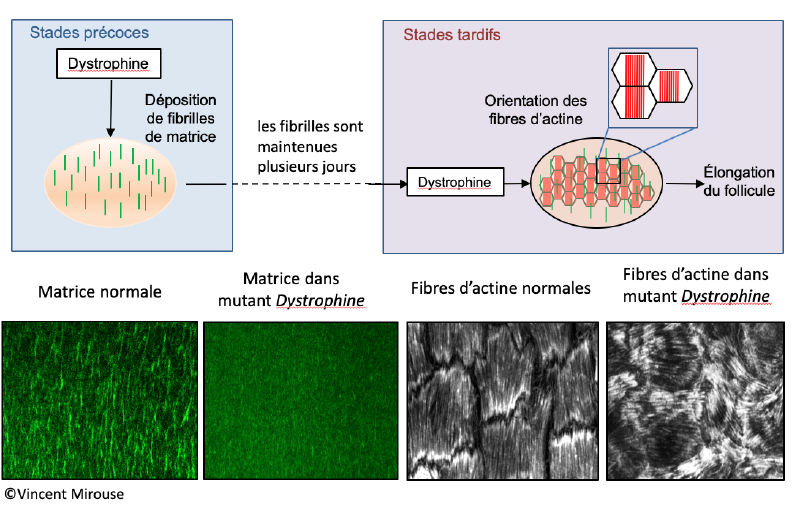
Des fonctions inattendues pour la dystrophine, impliquée dans la myopathie de Duchenne
Référence
Cerqueira Campos F, Dennis C, Alégot H, Fritsch C, Isabella A, Pouchin P, Bardot O, Horne-Badovinac S, Mirouse V. Oriented basement membrane fibrils provide a memory for F-actin planar polarization via the Dystrophin-Dystroglycan complex during tissue elongation. Development. 2020 Apr8;147(7):dev186957. doi: 10.1242/dev.186957. PMID: 32156755; PMCID: PMC7157587.